서 론
전자간증 산모에서 태어난 아기는 부당경량아(small for gestational age)의 유병률이 높고 혈소판 감소증의 유병률이 높다[1-4]. 또한 전자간증 산모의 출산 시기는 산모의 혈압의 중증도에 따라 결정되는데 심한 경우에는 태아를 일찍 분만하기도 하고 반대로 전자간증 자체가 조기 진통을 일으키기도 한다. 전자간증 산모의 아기에서 보이는 여러 가지 이상들은 극소 출생 미숙아의 장기적인 예후에 영향을 미칠 것이다.
산모의 고혈압이 태아의 폐성숙을 촉진시킨다는 보고들이 있었으나[5-7], 최근 다른 연구들에서 미숙아 호흡곤란증이나 만성 폐질환이 전자간증 산모의 아기에게서 더 심하게 나타난다는 보고가 있었다[8]. 또한 호흡곤란 증후군이나 기관지폐이형성증의 발현에 vascular endothelial growth factor (VEGF), placental growth factor (PlGF)와 같은 혈관생성인자와 관련이 있을 것이라는 추측들이 있어 왔다[9,10].
전자간증의 원인은 아직 명확히 밝혀지지 않았으나 두 가지 단계의 원인으로 생각되고 있다. 첫째는 정상 임신에서 보이는 나선 동맥의 태반 내 착상과 구조 변화가 일어나지 않아서 비정상적인 태반 형성이 일어나게 되며 두 번째로 전반적인 산모의 혈관 내피의 기능 부전으로 인한 혈관 수축과 단백질 소실로 인한 혈장 량의 부족으로 태반 이외 장기로의 혈류 공급이 부족하게 되어 간, 심장, 혈액 세포 등의 전신질환으로 이행하게 되는 과정이다[11]. 현재까지 여러 연구에서 soluble fms-like tyrosine kinase 1 (sFlt-1), soluble vascular endothelial growth factor receptor (sVEGFR-1)이 전자간증의 병태생리에 많은 관련이 있을 것이라고 알려져 있다[12-15]. sFlt-1은 VEGF와 PlGF와 결합하여 이들 혈관생성 인자가 조직에서 Flt-1과 상호작용하는 것을 막음으로써 혈관생성 작용을 방해하는 역할을 한다[16-18]. VEGF, PlGF가 전자간증 산모에서 Flt-1과의 상호작용을 통해 거핵구를 성숙시키고 이는 전자간증 산모의 아기에서 보이는 혈소판 감소증과 연관이 있을 것이라는 보고가 있었다[19].
이에 본 연구에서는 37주 미만의 미숙아를 대상으로 전자간증 산모의 아기와 정상 혈압을 가진 산모의 아기 두 군으로 나누어 제대혈 내 혈관 생성 인자, 부당경량아의 유무, 혈소판 수를 비교해 보았으며 전자간증 유무와 상관없이 호흡곤란증이 있는 환아와 그렇지 않은 환아 두 군으로 나누어 제대혈 내 혈관생성 인자를 비교해 제대혈내 혈관생성인자가 호흡곤란증을 유발하는 기전과 관련이 있는지 알아보았다.
방 법
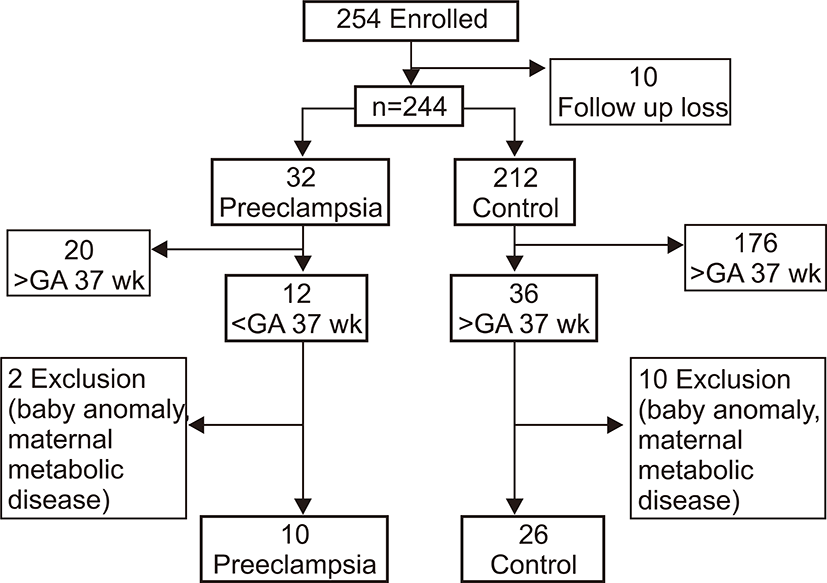
2006년 1월부터 2006년 8월 사이에 출생한 재태 연령 37주 미만의 미숙아 중 임신 중기부터 이화여자대학교 의과대학 부속 목동 병원에서 산전 관리를 받고 제대혈 채취에 대한 동의가 이루어진 환아를 대상으로 하였으며 본원 윤리 위원회(Institutional Review Board)의 심사를 통과하였다. 모체가 임신 중 융모양막염 등의 심한 염증성 질환을 앓았거나 혈소판 수에 영향을 미칠 수 있는 약물을 복용한 경우, 심각한 선천성 기형이 있는 경우, 출생 후 72시간 이내 사망한 경우는 제외하였다. 대상 환아는 36명(Fig. 1)으로 모체의 전자간증이 있는 경우가 10명, 전자간증이 없는 경우가 26명이었다. 대상 환아들의 평균 재태 연령은 34±2.6주, 평균 출생체중은 2,218±665 g이었고, 남아가 14명, 여아가 22명이었다.
제대혈을 분만 직후 채취하여 원심 분리하여 혈청을 채취하였으며 이 연구 대상 환아의 임상적 자료가 모두 수집될 때까지 -70oC 냉동고에 보관하였다가 일괄 분석하였다.
Sandwich enzyme linked immunosorbent assay (ELISA) 방법으로 VEGF R1에 특이적인 단일클론 항체가 코팅된 판에 검체를 넣어 반응시킨 후 세척으로 결합하지 않은 물질은 제거한 다음 효소와 결합된 다클론 항체를 넣었다. 세척으로 결합되지 않은 효소를 제거한 후 기질액(Human sVEGF R1, R&D System Inc., Minneapolis, MN, USA)을 넣어 반응시키면 sVEGF R1의 양과 비례하여 발색되는데 이 때 발색을 정지시켜 발색정도를 450 nm에서 측정하여 sVEGF R1의 양을 확인하였다(Versamax, Molecular Device, Sunnyvale, CA, USA; microplate reader). Intraassay variation과 interassay variation은 각각 3.2%, 7.4%였다. 민감도는 3.5 pg/mL이었다.
Sandwich ELISA 방법으로 PlGF에 특이적인 단일클론 항체가 코팅된 판에 검체를 넣어 반응시킨 후 세척으로 결합하지 않은 물질은 제거한 다음 효소와 결합된 다클론 항체를 넣었다. 세척으로 결합되지 않은 효소를 제거한 후 기질액(Human PlGF, R&D System Inc.)을 넣어 반응시키면 PlGF의 양과 비례하여 발색되는데 이 때 발색을 정지시켜 발색 정도를 450 nm에서 측정하여 PlGF의 양을 확인하였다(Versamax). Intraassay variation과 interassay variation은 각각 5.4%, 11.2%였다. 민감도는 7.0 pg/mL이었다.
Sandwich ELISA 방법으로 VEGF에 특이적인 단일클론 항체가 코팅된 판에 검체를 넣어 반응시킨 후 세척으로 결합하지 않은 물질은 제거한 다음 효소와 결합된 다클론 항체를 넣었다. 세척으로 결합되지 않은 효소를 제거한 후 기질액(Human VEGF)을 넣어 반응시키면 VEGF의 양과 비례하여 발색되는데 이 때 발색을 정지시켜 발색 정도를 450 nm에서 측정하여 VEGF의 양을 확인하였다(Versamax). Intraassay variation과 interassay variation은 각각 5.4%, 7.3%였다. 민감도는 9.0 pg/mL이었다.
환아의 임상 자료는 의무기록을 후향적으로 검토, 수집하였다. 모체의 전자간증이 있는 군과 전자간증이 없는 군으로 나누어 두 군 간의 제대혈 내 sFlt-1, PlGF, VEGF값, 출생 시 재태 연령, 출생체중, 1분 아프가 점수, 5분 아프가 점수, 산전 스테로이드 사용 여부, 호흡곤란증 유무, 출생 시 혈소판 수, 부당경량아 여부 등을 비교 분석하였다.
산모의 전자간증은 재태 연령 20주 이후에 수축기 혈압 140 mmHg 이상, 이완기 혈압 90 mmHg 이상이면서 24시간 소변 내 단백이 300 mg 이상 이거나 도뇨관 소변 검사에서 단백이 1+ 이상인 경우로 정의하였다. 산모의 산전 스테로이드 사용은 적어도 분만 48시간 전에 dexamethasone 총 20 mg을 2~4회로 나누어 투여받은 경우로 하였다. 미숙아 호흡곤란증은 흉부 방사선 소견에서 과립상 음영 또는 공기 기관지 음영이 있으면서, 분당 70회 이상의 빈호흡, 심한 함몰 호흡, 호기 시 신음, 40% 산소 치료에서의 청색증, 심한 흡기 부족, 지속적인 무호흡 등의 호흡기 증상이 있고, 동맥혈 가스 분석 상 60% 이상의 산소 공급 중에도 동맥혈 내 산소 분압이 50 mmHg 미만이고, 동맥혈 내 이산화탄소 분압이 60 mmHg 이상, 또는 pH가 7.25 미만인 경우로 정의하였다. 부당경량아는 출생체중이 자궁 내 성장곡선에서 10백분위수 미만인 경우로 정의하였다.
조사된 자료와 검사에서 임상 자료는 평균 값±표준편차로 표기하였으며 사이토카인의 값은 모두 중앙값으로 표기하였다. SAS ver. 9.1 (SAS Institute, Cary, NC, USA)을 이용하였고 임상 자료와 제대혈 내 혈관생성 인자들 평균 농도의 비교는 chi-square와 Mann-Whitney U test를 이용하여 분석하였고, 전자간증 산모군 내에서의 부당경량아 및 호흡곤란증 환아의 빈도는 Fischer’s exact test를 사용하였으며 각 변수 간 통계 수치의 상관성은 Spearman coefficient 분석법을 이용하여 분석하였다. 재태 연령 보정 후 출생 시 몸무게와 PlGF와의 상관성 분석에는 편상관분석(partial correlation analysis)을 이용하였으며, 모든 통계 값에서 P 값이 0.05 미만인 경우를 통계적으로 유의하다고 판정하였다.
결 과
전자간증이 있는 산모의 아기군과 전자간증이 없는 산모의 아기군 간의 재태 연령의 차이는 없었고(P=0.646), 출생 시 체중은 전자간증이 있는 산모의 아기군에서 전자간증이 없는 산모의 아기군 보다 의미 있게 작았다(1,861±484 g vs. 2,355±681 g, P=0.030) (Table 1). 또한 전자간증이 있는 산모의 아기군에서 전자간증이 없는 산모의 아기군에 비해 부당경량아가 더 많았다 (30% vs. 3.8%, P=0.057) (Table 1).
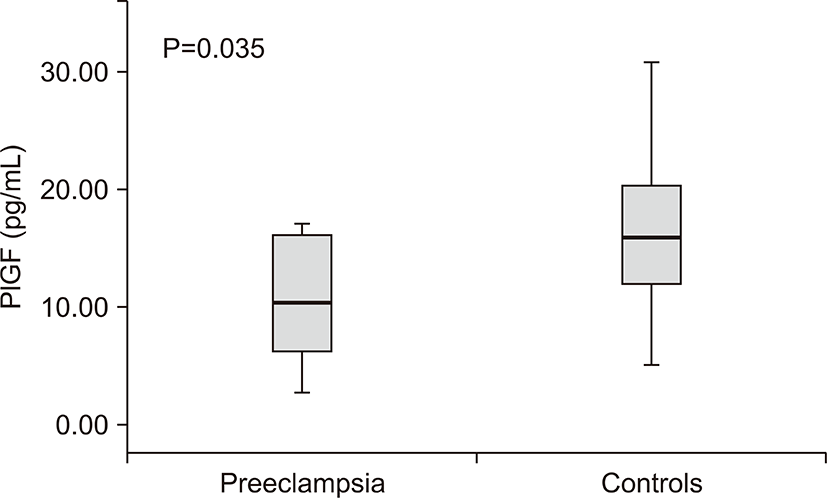
전자간증이 있는 산모의 아기군에서 전자간증이 없는 산모군에 비해 제대혈 내 sFlt농도는 차이가 없었고(206.50±138.64 vs. 137.54±72.19 pg/mL, P=0.204) (Table 2), PlGF 농도는 통계학적으로 유의하게 낮았다(10.85±5.19 vs. 16.07±6.78 pg/mL, P=0.035) (Table 2, Fig. 2). sFlt-1/PlGF 비는 전자간증이 있는 산모의 아기군과 전자간증이 없는 산모군에서 통계학적인 차이가 없었다(33.3±46.19 vs. 11.0±9.07, P=0.080). 제대혈 내 VEGF 농도는 두 군 간에 차이가 없었다(P=0.737) (Table 2).
전자간증이 있는 산모와 전자간증이 없는 산모의 분만 시 혈소판 수는 차이가 없었으며(P=0.560) (Table 3), 전자간증이 있는 산모의 아기군에서 전자간증이 없는 산모의 아기군에 비해서 출생 직후 시행한 혈액 검사 상 혈소판 수가 낮은 경향을 보였으며(P=0.064) (Table 3), 비정상 혈소판 범위인 150×103/µL 이하인 경우는 1명 있었다.
산모의 전자간증 유무에 관계없이 호흡곤란증이 있는 환아와 대조군으로 나누어 비교해 보았을 때 호흡곤란증이 있는 환아에서 제대혈 내 VEGF 농도만이 낮은 경향을 보였다(P=0.087) (Table 4).
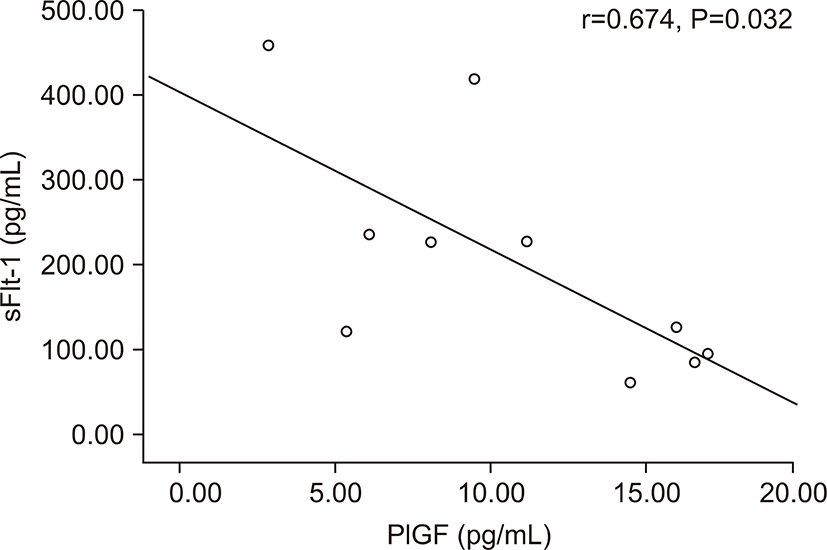
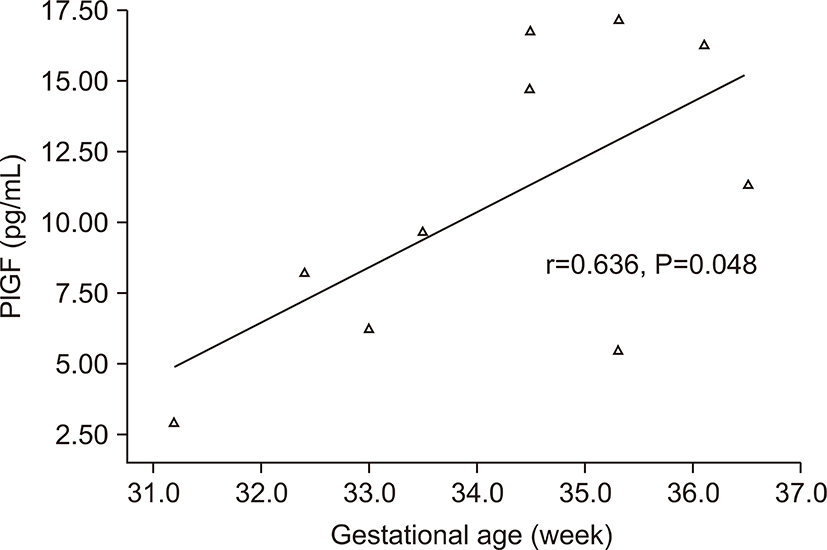
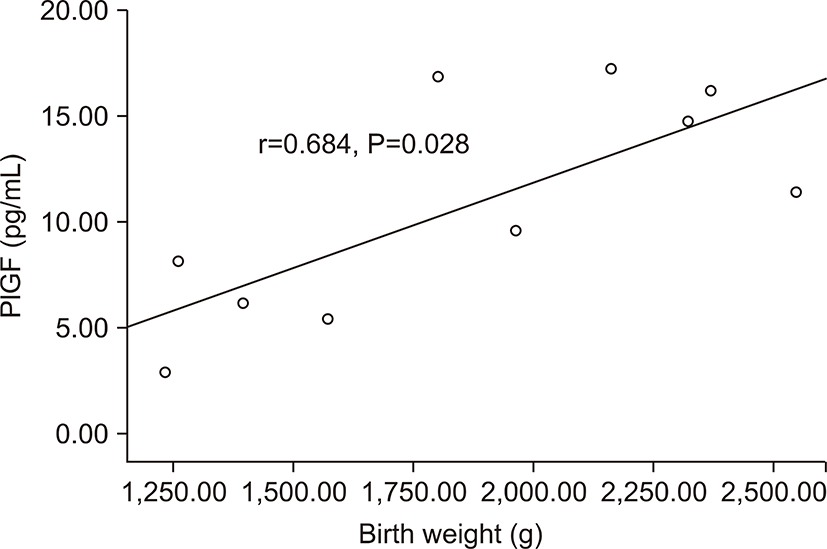
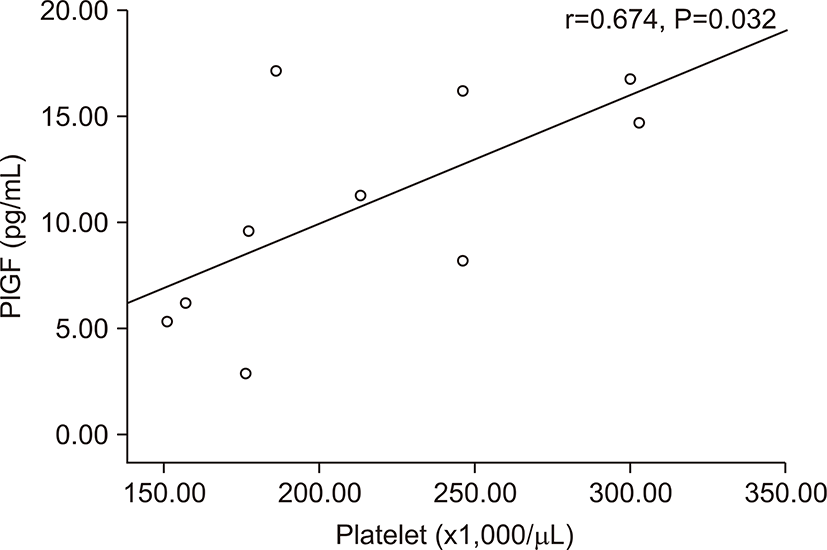
전자간증이 있는 산모의 아기군의 제대혈 내 sFlt-1농도는 PlGF농도와 음의 상관관계를 가졌다(r=-0.674, P=0.032) (Fig. 3). 그러나 출생체중, 출생 시 혈소판 수, 제대혈 내 VEGF농도와는 상관관계가 없었다. 전자간증이 있는 산모의 아기군의 제대혈 내 PlGF농도는 재태 연령과 양의 상관관계를 가졌으며(r=0.636, P=0.048) (Fig. 4), 재태 연령을 보정한 이후 편상관분석에서 PlGF와 출생체중은 양의 상관관계를 가졌다(r=0.685, P=0.028) (Fig. 5). 재태 연령을 보정한 이후 편상관분석에서 PlGF와 출생 시 혈소판 수는 양의 상관 관계를 보였다(r=0.675, P=0.032) (Fig. 6). 그러나 PlGF와 제대혈 내 VEGF농도와는 상관관계가 없었다. 제대혈 내 VEGF 농도는 재태 연령, 출생체중, 출생 시 혈소판 수와 모두 상관관계가 없었다.
고 찰
본 연구는 전자간증의 발생 및 병태 생리에 기여할 것으로 생각되는 sFlt-1, PlGF, VEGF의 제대혈 내 농도를 측정하여 비교한 결과, 전자간증이 있는 산모군에서 전자간증이 없는 산모군에 비해 제대혈 내 감소된 PlGF 농도를 확인하였다. 또한 전자간증 산모군에서 sFlt-1/PlGF의 비율이 증가되어 있었다.
전자간증의 원인은 아직 명확히 밝혀지지 않았다. 한 연구에서 전자간증 산모의 세포영양막이 상피형 세포에서 내피 형 형질로 변화 되는 과정이 실패하고 산모의 나선 동맥이 자라서 들어가는 과정의 실패를 보여 줌으로써 전자간증에서 태반의 혈관 생성의 결함이 있을 것이라는 주장을 보여주었다[20].
Flt-1은 2가지 형태로 존재한다. 하나는 세포막에 결합된 tyrosine kinase 수용체(Flt-1)로 혈관생성 신호를 전달하고, 또 한 가지는 수용성으로 분비된 세포 외 도메인(sFlt-1)으로 유일하게 VEGF와 PlGF와 결합한다[21]. sFlt-1은 세포막 사이, 세포 내 도메인이 없기 때문에 이 수용체의 기능은 유리 VEGF와 PlGF를 줄이는 역할에만 국한된다. 최근 순환되고 있는 잉여 sFlt-1이 전자간증의 병태 생리학적 역할을 할 것 이라는 연구들이 있었다[12-15]. 감소된 PlGF와 증가된 sFlt-1/PlGF의 비는 증가된 sFlt-1이 유리형 PlGF를 감소시켜서 태반내로의 혈관 생성을 저해하고 전자간증이 발생한다는 가설을 지지한다. sFlt-1의 농도는 임신 기간 동안 증가하여 임신 35주경까지 증가하다가 35주 이후에는 급격한 증가를 보이고 출산 이후 감소하는 경향을 보인다[15]. 또한 Maynard 등[18]은 정상 임신군, 경증의 전자간증, 중증의 전자간증 산모의 평균 혈청 sFlt-1을 비교해 보았는데, 정상 임신 군에서는 1.5±0.22 ng/mL, 경증 전자간증 산모군이 3.28±0.83 ng/mL, 중증 전자간증 산모군이 7.64±1.5 ng/mL로 전자간증의 정도가 심할수록 sFlt-1의 농도가 더 높은 것을 보여주었다. 그러나 본 연구에서는 전자간증 산모군과 정상 임신 군 사이에 sFlt-1의 제대혈 내 농도의 차이는 보이지 않았다.
PlGF는 정상적인 조직, 특히 태반, 갑상선, 폐에 많이 존재하는 VEGF family에 속하는 glycoprotein으로 혈관생성과 조혈작용에 중요한 역할을 하는 것으로 알려져 있다[22,23]. PlGF는 정상적인 임신기간 동안에 29-32주까지 꾸준히 증가하며 이후 감소하게 되는데 이는 33주에서 36주 사이에 크게 증가하는 sFlt-1의 작용이라고 생각된다[15]. Levine 등[17]의 연구에서도 sFlt-1과 PlGF가 길항작용을 하여 높은 sFlt-1 농도를 가진 산모가 낮은 PlGF농도를 갖는다고 하였는데 본 연구에서도 sFlt-1과 PlGF는 역의 상관관계를 가졌다. 또한 본 연구에서 전자간증 산모군에서 정상 임신 군에 비해 제대혈 내 PlGF 농도가 감소되어 있었다. 미숙아를 대상으로 한 본 연구에서 전자간증 산모군에서 PlGF는 출생 체중과 양의 상관관계를 보였는데, 전자간증이 심할수록 PlGF의 감소가 심하고, 이는 산모의 건강과 태아의 환경 호전을 위해 인위적으로 좀더 이른 시기의 조기 출산을 외부에서 유도하게 된다고 해석할 수 있다.
몇몇 연구에서 전자간증을 가진 산모군에서 증상 발현 이전에서 조차도 혈청 내 VEGF (총 VEGF가 아닌 유리형 VEGF의 농도), PlGF의 농도가 감소 된 것을 밝힌 바가 있다[24,25]. 또한 다른 연구에서는 태반의 혈류 공급의 감소로 인한 저 산소 상태가 태반내의 VEGF를 상향 조절하고 PlGF는 하향 조절한다는 보고도 있었다[26-28]. 본 연구의 결과에서는 VEGF가 전자간증 산모에서 오히려 증가된 결과를 보였다. 이는 유리형이 아닌 총 VEGF 농도를 측정하였으므로 앞서 연구 되었던 결과들과는 차이를 보였을 가능성이 있으며 태반의 혈류 부족으로 인한 저산소증으로 VEGF가 상향 조절되었다는 자료를 지지할 수 있다. 그러나 VEGF의 증가가 통계학적인 유의성은 없었으며 본 실험의 표본수가 부족하여 이 문제를 해결한 후의 재분석이 필요할 것으로 생각된다.
이번 연구에서 미숙아 전자간증 산모의 아기가 전자간증을 가지지 않은 산모의 아기에 비해 출생체중이 작을 뿐만 아니라 부당경량아의 유병률이 높았고, 혈소판 수가 감소 되어있는 사실을 확인 할 수 있었다. 그러나 혈소판이 μL당 150만 이하로 감소된 경우는 1명의 환아에서만 보였다. Casella 등[19]은 VEGF와 PlGF가 Flt-1를 매개로하여 거핵구를 성숙시키는데 기여한다고 보고하였는데 거핵구의 다분화 과정에서 sFlt-1을 첨가하였을 때 거핵구의 핵의 엽이 현저히 작아지는 것을 보여주었으며, 반대로 sFlt-1의 단세포군 항체를 투여했을 때는 거핵구의 엽이 많아져서 다분화가 촉진되는 결과를 보여주었다. Flt-1 신호는 거핵구의 발현을 조절하고 전자간증 산모의 아기에서의 신생아 혈소판 감소증 발현의 병태 생리에 연관이 있을 것이다. 본 연구의 결과에서는 전자간등 산모의 아기에서 정상 임신모의 아기보다 출생 직후 혈소판의 수가 낮은 경향을 보였으며, 이는 경계성 통계학적 유의성을 가졌다. 전자간증 산모에서 제대혈 내 PlGF의 농도가 신생아의 혈소판 수와 통계학적 유의성을 가진 양의 상관관계를 보여주었으나, sFlt-1, VEGF 농도는 혈소판 수와 상관관계가 없었다. Levine 등[17]은 전자간증을 가진 산모 중 부당경량아를 출산한 산모와 전자간증을 가졌으나 부당경량아를 출산하지 않은 산모의 혈중 sFlt-1 농도를 비교해 보았을 때 전자가 더 높은 sFlt-1 농도를 가진 것을 보여 주어 잉여의 sFlt-1, 즉 항 혈관 생성 인자가 전자간증으로 유발되는 부당경량아의 발현에 역할을 할 것이라고 예측했다. 또한 Shibata 등[13]의 연구에서 전자간증을 가지지 않은 부당경량아를 낳은 산모에서는 산모의 태반과 혈청 내 sFlt-1의 농도가 증가하지 않는 다는 것을 보여주었다. 실제 본 연구에서는 전체 산모에서는 제대혈 내 sFlt-1의 농도와 신생아의 출생체중과 경계성 유의성을 가진 음의 상관관계를 보여 주었으나, 전자간증 산모에서는 sFlt-1 농도와 신생아의 출생체중과는 상관관계가 없었다. 이는 전자간증 산모가 10명으로 표본 수의 부족으로 통계학적으로 의미 있는 결과를 도출하기에는 어려움이 있었다. 본 연구에서 전자간증을 가진 산모에서 부당경량아를 낳았든 낳지 않았든, sFlt-1은 증가되어 있었다. 그러나 이도한 통계학적인 유의성이 없었으므로 이는 추후 표본 수 보충 후의 재분석이 필요할 것이다. Shibata 등[13]의 연구에서 전자간증을 가진 산모에서 sFlt-1이 증가 하지 않은 경우에도 부당경량아를 가진 경우에는 PlGF가 의미 있게 감소되어 있었다는 결과를 보여주었는데 본 연구에서도 제대혈 내 PlGF 농도와 출생체중과 양의 상관관계를 보였다. 결국 증가된 sFlt-1이 부당경량아에서 감소된 PlGF를 모두 설명할 수는 없으며 전자간증 유무와 상관없이 태아 성장 지연이 있는 경우에는 PlGF의 감소가 관련이 있으며 결국 부당경량아의 발생은 근본적인 태반의 차이가 원인일 것이라는 예측을 할 수 있었고[29,30], 본 연구의 결과도 이와 일치했다.
본 연구의 대상아들이 재태 연령 37주 미만의 미숙아이므로 제대혈 내 VEGF, sFlt-1 (VEGF R1), PlGF의 농도가 미숙아 호흡곤란증 및 기관지폐이형성증과 관련이 있는지를 같이 분석해 볼 수 있었다. 이전의 다른 연구들에서 호흡곤란증이 있는 환아에서 제대혈 내 VEGF 농도가 감소되어 있고, 이러한 환아에서 기관지폐이형성증이 발현될 가능성이 높다는 견해와[31,32], Tsao 등[10]이 발표한 과다 생성된 제대혈 내 PlGF가 기관지폐이형성증의 예측인자로 사용될 수 있다는 가설 등을 비교하여 볼 때 본 연구는 호흡곤란증을 가진 환아에서 제대혈 내 VEGF농도가 낮은 경향을 보였으며 이는 통계학적으로 경계성 유의성을 보였다. 그러나 그 밖에 PlGF, sFlt-1의 농도는 호흡곤란증이나 기관지폐이형성증과 관련이 없었다. 그러나 본 연구에서 호흡곤란증 환아가 10명, 기관지폐이형성증 환아가 3명 포함되어 수 적인 부족으로 인해 통계학적 의의를 찾기는 어려웠다. 새로운 기관지폐이형성증의 개념으로 볼 때 폐 내에 존재하는 혈관생성 인자인 PlGF, VEGF 등의 농도가 기관지폐이형성증의 예측을 가능하게 할 수 있을지는 좀더 연구해 보아야 할 것이다.
본 연구는 전자간증 산모에서 태어난 신생아 중 이환율이나 사망률이 특히 높을 수 있는 미숙아를 대상으로 한 연구를 시행 하였으나 표본 수의 부족이라는 제한점을 가지고 있다. 이러한 제한점을 극복하기 위하여 작은 표본 수에서 의미를 해석할 수 있는 비모수 검정을 시행하였으며, 유의한 결과를 보인 것은 PlGF였다. PlGF 변수는 검정력을 계산 해 본 결과 60%의 power를 가지는 것으로 나타났다(G-power program). 그러므로 PlGF와 관련된 결과 도출에는 무리가 없었을 것으로 생각되며, 나며지 변수에 대한 결과는 향후 더 많은 대상자를 통해 연구를 시행하여 검정력을 확보해야 할 것이다. 또한 본 연구는 미숙아를 대상으로 한 결과 분석으로 각 주수에 따른 혈중 내 변수들의 농도 변화 체중, 제태 연령의 차이 등이 결과 해석에 혼란을 줄 수 있는 점을 감안하여, PlGF 출생시 체중과의 상관 관계 분석시에는 재태 연령을 보정한 후 상관 관계를 분석하는 편상관분석(partial correlation)을 이용하였다.
결론적으로 증가된 sFlt-1과 감소된 PlGF는 전자간증 발생의 병태 생리와 연관이 있으며 전자간증 발생 과정에서 일어나는 태아의 질병 이환에 대한 예측이 가능한지 좀더 연구해 보아야 할 것이다.