서 론
신장이식은 말기신부전 환자에서 최선의 치료이다. 따라서 많은 말기신부전 환자들이 신장이식을 기다리고 있고, 신장이식 대기자 수는 매년 증가되어 우리나라에는 2013년 기준으로 14,181명에 달한다. 반면 지난 십 수년간 공여자의 수는 계속해서 늘어나는 수여자의 수에 비해 턱없이 부족하며, 2013년에는 총 1,760명만이 신장이식을 받을 수 있었다. 공여 신장의 심각한 수요와 공급의 불균형은 전세계적인 문제로서 신 공여자의 범위를 재정비하여, 현재는 심정지된 공여자, 경계상 공여자까지 범위가 확대되었다. 우리나라는 2000년 2월 9일부터는 뇌사자에 대한 장기 이식에 관한 법률이 시행되어 국립장기이식관리센터(Korean Network for Organ Sharing)에서 뇌사자 이식을 적극적으로 시행하고 있다[1]. 이와 같은 정책적 지원과 인식의 변화로 2000년 100건이었던 뇌사자 신장이식이 2013년 748건으로 증가했으나 이식대기자 수를 채우기에는 여전히 뇌사자 공여 신장은 매우 부족한 형편이다[2].
1901년 사람의 혈액형이 발견된 후 적어도 수십 년 동안 혈액형 부적합 신이식은 그로 인해 예상되는 초급성 거부 반응으로 인해 금기시 되었었다. ABO 혈액형 부적합 신장이식은 1955년 Hume 등[3]에 의해 처음으로 보고되었는데, B형 뇌사자와 O형 수혜자간 이식으로 당시에는 항 ABO 항체의 임상적 의미에 대한 이해부족과 항체 제거를 위한 전처치의 부재 때문에, 혈액형 불일치 신장이식을 시행한지 1주 만에 초급성 거부반응의 발생으로 이식 실패로 끝났었다. ABO 혈액형 부적합 신이식의 성공은 1985년 Alexandre 등[4]이 혈장교환 및 비장적출 등의 이식 전 전처치 후 ABO 부적합 신장이식에서 처음 보고하였고 이후 ABO 부적합 신장이식에 대한 연구가 시작되었다. 일본에서 뇌사자 장기 기증과 그 수급이 적절치 않아, ABO 혈액형 부적합 신장이식의 필요성에 대한 목소리가 높아지면서 1989년부터 혈장교환술과 비장적출술을 이용한 혈액형 부적합 신장이식이 본격적으로 시행되었다[5]. 1990년대 중반까지의 ABO 부적합 신장이식의 성적은 ABO 적합 신장이식에 비하여 좋지 못하였으나[6], 1990년대 후반 tacrolimus와 mycophenolate mofetil과 같은 강력한 면역억제제가 도입되면서 ABO 부적합 신장이식과 차이가 없는 좋은 성적이 보고 되었다[7]. 2003년 스웨덴에서 림프종 치료에 쓰여 오던 항 CD20+ 단일 클론항체인 rituximab을 전처치에 도입하였고, 일본에서도 비장적출술 대신 rituximab을 이용한 ABO 혈액형 부적합 신장이식을 시행하여 환자 생존율과 이식신 생존율에서 ABO 적합 신장이식에 준하는 성적의 향상을 보고하였다[8]. 한국의 경우 2007년 처음 혈액형 불일치 신장이식이 성공적으로 시행된 이후 현재는 많은 센터에서 시행하고 있고, 2013년 전체 신장이식의 21.7%를 차지할 정도로 비중이 크게 증가하였다[2]. 이에 성공적인 ABO 혈액형 부적합 신장이식은 공여 장기의 제한을 극복할 수 있는 대안으로 여겨지고 있다. 본문에서는 ABO 혈액형 부적합 신장이식의 특징과 거부반응 억제 전략에 대해 살펴 보고 그에 따른 과제에 대하여 논의해 보고자 한다.
본 론
ABO 혈액형 불일치 신장이식과 일반적인 이식의 가장 큰 차이점은 ABO 항원이 혈관내피세포 및 세뇨관 상피세포에도 표현되어 있어, 수혜자의 혈액에 존재하는 항 ABO 항체와 반응하여 보체계를 포함한 항체 의존성 세포독성 기전을 활성화시켜 초급성 또는 급성 항체 매개성 거부 반응을 일으킨다는 점이다[9]. 따라서 이식 준비과정에서 항 ABO 항체의 역가를 평가하고, 적절한 전처치를 시행하여 항체 역가를 목표치까지 감소시킨 후 이식을 시행하여야 한다. 일반적으로 받아들여지는 프로토콜이 정해져 있는 것은 아니나 항ABO 항체를 극복하기 위한 전략은 다음과 같다. 첫째, 혈장반출술(plasmapheresis) 또는 면역흡착술(immunoadsorption)에 의한 이식 시 항체 antibody depletion 유도, 둘째, 경정맥 면역글로블린 투여를 통한 수혜자 면역 체계의 modulation, 셋째, 비장적출술이나 대체 가능한 약제인 항CD20+ 단일 클론 항체인 rituximab을 통한 B-림프구 생성억제, 넷째, proteasome inhibitor (bortezomib)을 통한 항체생성 방해, 다섯째, C5에 대한 단일클론 항체(eculizumab)로 항체매개성 거부 반응 억제, 마지막으로 강력한 면역억제제의 유지로 요약될 수 있다.
수혜자의 혈액 내에 존재하는 항 ABO 항체를 제거하는 목적으로 혈장반출술을 시행한다. 혈장반출의 장점은 우수한 치료효과를 기대할 수 있고 교차반응으로의 음전시기를 어느 정도 예측할 수 있다는 것이다. 그러나 그 비용이 고가이고, 혈장반출 치료를 위한 특별 인력이 필요하며 응고인자의 제거, 저칼슘혈증, 고열 또는 오한 등의 부작용이 발생할 수 있다. 혈장반출술의 방법은 국가 또는 센터마다 차이를 보인다. 미국에서는 전혈장 교환술(total plasma exchange)을 사용하는데, 최근 한 연구에서는 혈액형 불일치 신장이식에서 1995년부터 2010년까지 전혈장 교환술과 저용량의 경정맥 글로블린의 병합요법을 사용하여 738명의 환자에서 시행하였을 때, 이식 초기 1년간의 누적 이식신 생존율은 5.9%로 이는 혈액형 적합 신이식에서 2.9%의 이식신 생존율보다 높았으며, 이식신 기능소실(graft loss)이 발생하는 경우에는 대부분 수술 후 2주 이내에 나타나는 것으로 조사되었다[10]. 이에 반해 일본의 경우, 이중 필터 혈장분리 교환술(double filtration plasmapheresis, DFPP)방법을 주로 사용한다. 2001년부터 2010년에 이중 필터 혈장분리 교환술과 비장적출술 대신 rituximab을 사용한 최근의 코호트 연구에서 1년 생존율 98%, 이식신 생존율 96%, 9년 생존율 91%, 이식신 생존율 83%의 성적을 보고한 바 있는데 이는 혈액형 적합 신이식의 성적과 비교하여 거의 차이가 없는 우수한 결과였다[9]. 스웨덴을 비롯한 유럽에서는 항 ABO 항체만을 특이적으로 흡착할 수 있는 면역흡착술(immunoadsorption)을 주로 사용하는데 2003년 스웨덴의 Tyden 등[8]은 특이 항 ABO 항체를 이용한 면역흡착술과 rituximab을 사용함으로써 혈액형 부적합 신이식의 새로운 장을 열게 되었다. 이러한 병합 요법의 성적은 4.5년의 평균 추적기간 동안의 환자생존율은 93%, 이식신 생존율을 91%이었으며, 항 AB 항체와 관련된 급성 항체 매개성 거부반응은 없었다고 보고하였다[11]. 독일에서는 소규모 연구였지만 항원 특이 면역흡착술 대신 비특이적 면역흡착술을 사용하였을 때, 12명의 환자에서 탈감작에 성공하였으며 그 항AB 항체의 역가가 항원 특이 면역흡착술과 비교하였을 때 차이가 없다는 결과를 발표하였다[12]. 한편 호주의 한 연구에서는 혈액형 부적합 신이식에서 비장적출술이나 rituximab의 B림프구에 대한 억제 치료 없이 혈장반출술과 저용량의 경정맥 글로블린의 병합 요법으로도 37명의 환자에서 26개월의 추적에서 이식신 생존율 100%를 달성하였고, 가역적인 항체 매개성 거부반응은 두 명에서 발생하였다고 보고한 바 있다[13].
혈장반출술 종류에 따라 물질을 반출하는 원리 및 물질의 선택성에서 차이를 보이지만, 항체 제거 효과 및 이식 이후 임상적 경과가 방법에 따라 차이를 보이는지에 대해서는 아직까지 명확히 알려진 바가 없다[14]. 따라서 혈장반출술 방법 중 특정 방법이 특별히 권고되지는 않으며, 기관별로 다양한 방법을 선택하여 사용하고 있다. 우리나라에서는 대부분의 이식 센터에서 전혈장 교환술을 사용하고 있고, 일부 센터에서 이중 필터 혈장분리 교환술 방법을 사용하고 있으나 아직까지 그 비교 연구는 부족한 실정이다.
ABO 혈액형 부적합 신이식에서와 달리, Human leukocyte antigen(HLA) 부적합 신이식에서 경정맥 면역글로블린 요법에 대한 연구는 많은데, 다기관 National Institutes of Health (NIH)의 연구를 포함한 몇몇 연구에서 경정맥 면역글로블린 단독 요법이 HLA 부적합 신이식에서 탈감작에 효과가 있었다고 보고한 바 있고, 2013년 Vo 등[15]은 Panel reactive antivody(PRA)가 80% 이상으로 감작된 신이식 수혜자 코호트 연구에서 경정맥 면역글로블린과 rituximab의 병합요법으로 전처치 하였을 때 2년 이식신 생존율이 87.5%의 좋은 성적을 발표하였다. 반면, Alachkar 등[16]은 100% PRA를 가진 27명의 이식 대기자를 분석하였을 때 고용량의 경정맥 면역글로블린을 전처치 하였더라도, HLA 항체 프로파일의 의미 있는 변화는 없었다고 보고한 바 있어 HLA 부적합 신이식에서 경정맥 면역글로블린 요법은 이식센터마다 다른 프로토콜을 따르고 있다. 한편, ABO 혈액형 부적합 신이식에서 고용량의 경정맥 면역글로블린 단독 요법에 대한 연구는 거의 없는 상태로, 많은 신이식 센터에서 BK 바이러스 감염과 같은 기회감염에 대비하여 저용량의 경정맥 면역글로블린 요법(100~500 mg/kg body weight)을 혈장반출술과 병합하여 사용하고 있다[17,18]. 면역글로블린이 항체 매개성 거부반응을 예방하는 기전은 확실히 알려져 있지 않으나 일반적으로 제시되는 기전은 단핵구의 Fc 수용체의 차단, alloantibody에 대한 직접적인 중성화, 활성화된 B림프구의 CD19에 대한 발현 억제, 보체 및 alloreactive T림프구의 억제이다[19,20]. 또한 혈장반출술 후 조직 및 림프관으로부터 혈액으로 이동하는 항ABO 항체로 인하여 역가의 반등이 일어날 수 있는데, 면역글로블린은 이를 억제하는 효과가 있는 것으로 알려져 있다[12]. 안타깝게도 현재 우리나라에서는 보험 급여 혜택을 받을 수 없어 사용하지 않는 센터도 있다.
Rituximab은 B림프구 표면에 특이적으로 표현되어 있는 CD 20에 대한 단일 클론 항체이다. 본래 악성림프종 치료제로서 개발되었으나, B림프구를 선택적으로 파괴하는 특징을 이용, 이식환자의 체액성 면역 반응을 억제할 목적으로 2000년대 초반부터 신장이식 분야에서 사용되기 시작되었다. ABO 혈액형 불일치 신장이식에서 초창기에 체액성 면역반응을 억제할 목적으로 시행되던 비장적출술은 수술 후 감염성 합병증에 의한 사망률을 증가시키고, 대부분의 기억 B 세포(memory B cell)가 비장이 아닌 골수에 존재한다는 연구결과에 근거하여 더 이상 권고되지 않고 rituximab으로 대체되고 있다[21,22]. Kohei 등[23]은 rituximab을 사용한 ABO 혈액형 부적합 신이식과 rituximab을 투여 받지 않은 혈액형 적합 신이식의 성적을 비교하였는데, rituximab을 투여 받은 혈액형 부적합 신이식의 2년째 chronic antibody mediated rejection (AMR)의 발생률과 제공자 특이 항체(donor specific antibody, DSA)의 de novo 발생률이 rituximab을 투여 받지 않은 혈액형 적합 신이식에서보다 낮았던 것으로 보고하여 이식 당시의 B림프구 면역상태가 항체매개 이식편 손상을 감소시켰을 것으로 추정하였다. Rituximab의 투여시기는 각 이식센터마다 차이가 있으나 대개 이식 2주에서 1개월 전 투여한다. 초기에는 악성 림프종의 사용량을 투여하였으나 현재는 저용량 rituximab요법을 사용하는 센터가 늘고 있고, 일반적인 용량을 사용한 경우과 비교하여 성적에 차이가 없는 것으로 보고되고 있다.
Rituximab은 B림프구에 특이적으로 작용하는 약제이므로, 항체를 생산하는 형질세포에는 작용하지 않는다[24]. Proteasome inhibitor인 bortezomib은 본래 다발성 골수종의 치료제로 사용되어 왔다. 골수 내에서 형질세포의 고사를 유도할 수 있어, 궁극적으로는 항체의 생산을 억제하는 작용을 한다. 이에 refractory AMR에 효과적이라는 보고가 있지만[25,26], 이식 전 탈감작 효과에 대해서는 아직 근거가 부족한 실정이다. Wahrmann 등[27]은 두 명의 감작된 환자에서 bortezomib을 두 번씩 사용하였을 때 HLA동종항체나 항A/B reactivity가 감소되지 않았다고 보고하였으며 이는 다른 연구에서도 확인된 바 있다[28]. 따라서 탈감작 치료에서 단독으로 사용되기 보다는 rituximab 및 혈장반출술 치료 후에도 음성전환이 이루어지지 않는 환자에서 주로 사용되고 있다.
보체 C5에 대한 monoclonal inhibitory antibody로 작용하여 항체매개성 거부반응에 필요한 membrane attack complex의 형성을 저해한다고 알려져 있다. 초기 발작성 야간 혈색소뇨증의 치료제로 미국 FDA 승인을 받아 교차반응 양성 환자의 탈감작 도입요법에 사용되기 시작하였다[29]. ABO 혈액형 부적합 신장이식에서도 탈감작에 eculizumab이 효과적이었다는 몇몇 보고가 있으나[30-32], 아직까지는 증례보고의 형태로서 향후 재평가가 필요하다.
이식 7일 전부터 면역억제제를 투여하는 것이 2일 전 투여하는 것보다 급성거부반응의 발생이 적다는 보고에 근거하여, 대부분의 센터에서는 이식 7일전부터 면역억제제 투여를 시작하고 있다. 혈액형 부적합 신이식에서는 칼시뉴린 억제제 중 tacrolimus가 cyclosporine과 비교하여 이식신장의 생존율이 우수한 것으로 알려져 대부분 센터의 프로토콜은 이식 1주 전 tacrolimus에 기반한 3제 요법(tacrolimus, corticosteroid, mycophenolate)이 선호되고 있다[33].
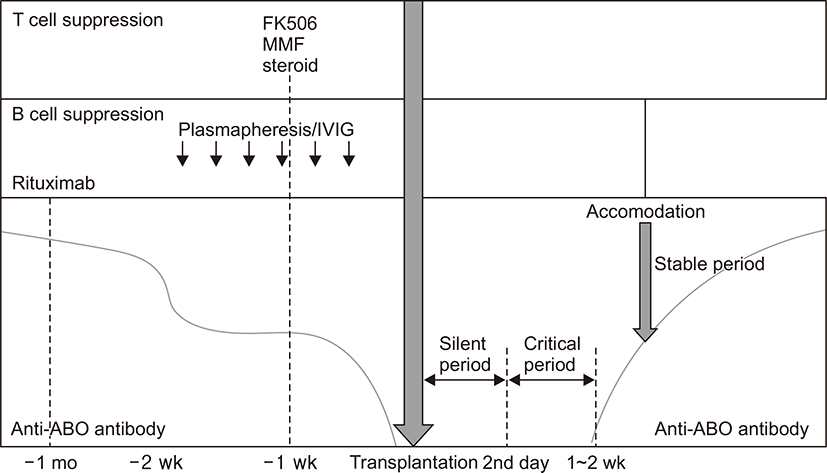
이와 같이 혈액형 부적합 신장이식에서 최적의 이식을 위한 여러 약제가 개발되고 임상 시험 중에 있으나 해결되지 않은 숙제들이 몇 가지 남아있다. 첫째로 수술 전 항ABO 항체를 어느 수준까지 제거해야 하는가에 대한 문제를 들 수 있다. 스웨덴과 독일에서는 1:4 이하로 상대적으로 낮은 역가까지 감소시키고 있고[34,35], 일본의 경우 1:32 이상에서 acute AMR의 발생률이 높아진다는 보고에 근거하여 1:16 이하로 목표하고 있다[36]. 이식 후 1~2일은 silent period 라 하여 항ABO 항체가 이식신을 공격하지 않는 기간 이후부터 14일까지의 기간을 critical period라 하고 acute AMR의 위험이 가장 높은 시기로 대부분의 센터에서 이 시기에 항체의 반등을 보일 경우 혈장반출술을 시행하고 있다(Fig. 1) [9]. 한편 기저 역가에 따라 환자마다 다른 횟수의 혈장반출술을 필요로 하게 되는데, Johns Hopkins Hospital에서는 기저 역가에 따른 이식 전후 혈장반출술의 횟수를 제시한 바 있다[37]. 기저 역가가 높을수록 목표 역가에 도달하기 위해 시행되는 혈장반출술의 횟수가 증가됨을 볼 수 있는데 중요한 것은 기저 역가에 따라 목표 역가에 도달하기 위해 시행되는 혈장반출술의 횟수는 정비례 관계가 아닌 기하급수적인 증가를 보인다는 것이며 결국 높은 기저 역가는 목표하는 역가까지 효과적으로 감소되기 어려우므로 신이식 후 항체 매개성 거부반응의 증가 및 이식신의 나쁜 예후와 연관이 있다는 것이다[38,39]. 그러나 높은 역가의 기준이 센터마다 다르고 그에 따른 면역억제제 프로토콜이 있어 목표 역가를 합일화하는데 어려움이 있다. 항ABO 항체와 관련해서 또 다른 문제점은 측정방법에 대한 문제이다. 현재 가장 많이 사용되고 있는 시험관법(test tube method, saline tube method)보다는 젤 카드 측정법(gel column agglutination method)이 측정자 오류가 적다는 장점이 있으나, 비용이 많이 드는 단점이 있어 현실적으로 임상에 적용하기에 무리가 있으며 한 연구에 따르면 검사 기관에 따라 역가 측정 결과가 달라서[40] 우리나라 실정에 맞게 표준화한 항체 측정방법이 필요하다.
둘째로 항체 생산 세포를 억제하기 위한 최적의 면역 억제 도입요법에서 약제 선택 문제를 들 수 있다. 앞에서 언급한 대로 rituximab이 비장절제술을 대체하고는 있지만, rituximab의 용량과 투여 시기에 대해서 이견이 분분하다. 초기에는 악성 림프종에서의 치료 용량과 같이 375 mg/m2 투여하였으나 현재는 총 용량 100~200 mg의 저용량을 투여하였을 때에도 임상경과에 거의 차이가 없는 것으로 보고되고 있다[41,42]. Rituximab이 CD 20+ B림프구를 충분히 감소시키기 위해서는 적어도 1주일은 걸리므로 수술 직전에 주사할 경우 거부반응이 잘 오는 초기에 충분히 감소되지 않아 효과가 없을 수 있고, 혈장반출술 중 투여하는 경우에는 혈장반출술에 의해 제거되어 효과가 감소하므로 혈장반출술 1~2주전에 투여하는 것이 바람직한 것으로 알려져 있다[43]. 우리나라의 경우 혈액형 부적합 신이식을 시행하는 전체 기관 중 53%에서 250 mg/m2 미만의 저용량 rituximab을 사용하고 있는 것으로 조사되었다[44]. 한편, 최근 도입되기 시작한 bortezomib이나 eculizumab 등에 대해서도 비교 연구가 필요하다.
마지막으로 혈액형 부적합 신장이식의 구별되는 치료와 연관된 부작용에 관한 문제를 들 수 있다. 현재 혈장반출술에 의한 비특이적 항체 제거에 의한 감염 위험성의 증가 외에도, rituximab 사용에 따른 진균 감염 및 거대세포 바이러스 감염, 폐포자충 감염 등 기회 감염에 의한 사망위험도가 높아진다고 알려져 있다[45]. 따라서 이를 고려한 감염 예방 프로토콜 개발이 필요하다.
한국의 혈액형 불일치 신장이식에 관한 연구를 살펴보면, 2007년 14명의 환자를 대상으로 한 첫 번째 보고가 있었다[46]. 이후 2011년 38건의 혈액형 불일치 신장이식에 대한 보고에서 rituximab과 혈장교환술의 병합용법을 사용한 1년간의 추적 결과, 술전 도입요법에 경정맥 면역글로블린을 사용하지 않고도 성공적인 신이식에 대한 가능성을 제시하였으나, 6명 이상의 감염률을 보여 경정맥 면역글로블린을 사용하지 않은 것이 감염으로 인한 사망률에 어떠한 영향을 미쳤는지 불분명한 제한점이 있었던 한편, 감염위험성에 대한 주의를 반증하였다[47]. 2012년 45명의 환자를 대상으로 한 연구에서는 혈장교환술과 경정맥 면역글로블린의 병합요법을 시행하였는데, 2명의 감염이 발생하였고, rituximab을 375 mg/m2을 투여한 군과 100 mg의 고정 용량을 투여한 경우를 비교하였을 때 급성 항체매개성 거부반응이 고용량 군에서 33명 중 3건이 발생한 것에 비하여 저용량 군의 12명 중에서는 발생하지 않아 저용량의 rituximab 유도 요법의 임상적 유용성을 확인할 수 있었다[48]. 그러나 우리나라의 혈액형 부적합 신이식의 역사가 길지 않아 혈액형 부적합 신이식의 증례가 많지 않고 추적기간이 짧은 제한점이 있어 이를 극복하기 위해 면밀한 고찰이 필요하다.
결 론
신이식 대기자 수는 폭발적으로 증가하고 있으나 이에 비해 신장 기증은 부족한 형편으로 그 대안으로서 혈액형 부적합 신이식에 대한 관심이 증대되고 있다. 최근 면역 억제제의 발전과 적절한 전처치로 혈액형 부적합 신이식의 성적이 혈액형 적합 신이식의 그것과 비견할 만한 발전을 이루었으나 구체적으로 면역억제 도입에서 어떤 약제를 어느 정도의 용량으로 얼마간 사용할지에 대한 일반적인 프로토콜이 정해지지 않은 상태이며, 이식에 적합한 항ABO 항체의 목표 역가 또는 역가 검사방법의 표준화가 정립되지 않은 상태로 이를 위해서는 더 많은 연구와 고찰이 필요할 것이다.