서 론
최근 발표된 2018년 국가암등록통계 자료에 의하면 대장암은 2012년 이후 발생률이 감소 추세이나 아직 전체 암환자의 11.4%를 차지하며 갑상선암을 제외하면 위암, 폐암에 이어 세 번째로 흔하다[1]. 치료의 발전으로 1993–1995년과 비교하여 2014–2018년의 상대생존율이 18.1% 상승되었지만 대장암 환자의 25%에서는 진단 당시 전이가 동반되며 치료의 발전에도 불구하고 절제가 불가능한 전이성 대장암 환자들의 중앙생존기간은 25–30개월 정도로 이를 해결하기 위한 새로운 전략이 필요하다.
최근 전이성 대장암에서 새로운 바이오마커들이 발견되면서 다양한 치료전략이 가능하게 되었다. Epithelial growth factor receptor (EGFR), Kirsten rat sarcoma viral oncogene homolog (KRAS), B-Raf proto-oncogene, serine/threonine-protein kinase (BRAF) 변이, 현미부수체 불안정(microsatellite instability, MSI), 불일치복구 결핍(mismatch repair deficiency, dMMR), human epidermal growth factor receptor 2 (HER2) 증폭, neurotrophic tyrosine receptor kinase (NTRK) 융합유전자 등이 대표적 예측 바이오마커로 각각의 바이오마커와 연관된 억제제들이 실제 임상치료에 도입되고 있다. 본 글에서는 전이성 대장암 치료에서 연구되고 있는 표적치료와 연관된 예측 바이오마커 그리고 관련 임상연구 및 실제 임상에서 적용하고 있는 치료지침을 정리하고자 한다.
본 론
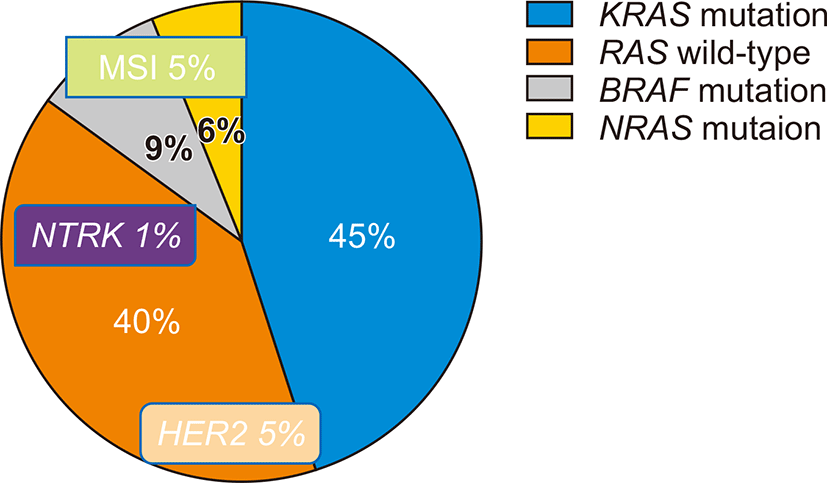
EGFR은 세포막당단백질 수용체로 리간드가 EGFR에 결합하면 세포 내 tyrosine kinase가 인산화 되면서 신호전달체계가 활성화되고 암세포의 증식, 전이, 신생혈관생성 등이 일어난다. 하위 신호인 KRAS와 neuroblastoma rat sarcoma viral oncogene homolog (NRAS)의 변이를 가진 대장암은 EGFR 차단제에 저항성을 가지기 때문에 Rat sarcoma viral oncogene homolog (RAS) 야생형의 경우에만 cetuximab같은 EGFR 단클론항체의 사용이 가능하며 cetuximab이 EGFR에 결합하게 되면 세포 내 신호전달체계가 중단되고 암세포의 증식이 억제된다[2]. 대장암 환자의 40–50%에서 KRAS 변이를 보이고 NRAS는 4–8% 정도 확인된다(Fig. 1) [3]. RAS 변이 외에도 EGFR ectodomain의 변이, mitogen-activated protein kinase (MAPK) 신호전달경로에서 BRAF 같은 EGFR 하위경로의 과활성화[4], PTEN 소실 등으로 인한 PI3K/Akt/mTOR 경로의 활성화, HER2나 MET 과발현 등이 EGFR 차단제에 저항성을 보이는 기전으로 작용한다.
1) EGFR 차단제의 임상적용
대장암 3기 수술 후 보조요법으로 EGFR 단클론항체(cetuximab, panitumumab)와 항암제의 병합치료는 생존기간을 향상시키지 못했다[5]. NEW EPOC 연구에서는 절제가능한 전이성 대장암에서 수술 전후 항암제와 cetuximab의 병합요법을 비교하였고 병합요법이 무병생존율과 전체 생존율을 오히려 악화시켰다[6]. 이러한 결과로 절제가능한 전이성 대장암에서 수술 전후 EGFR 단클론항체의 사용을 권고하지 않지만 잠재적으로 절제가 가능한 전이성 대장암에서 암을 크기를 줄여 전환치료를 고려하는 경우에는 유용할 수 있다[7].
전이성 대장암의 일차 혹은 후속 치료로 cetuximab과 panitumumab을 oxaliplatin 혹은 irinotecan 기반의 항암제와 병용하였을 때 반응률 및 질병진행, 생존기간을 향상시켰다[8]. NORDIC VII와 MRC COIN 연구에서는 cetuximab을 oxaliplatin을 포함한 요법에 추가하였을 때 추가적인 효과를 입증하지 못했으나[9,10], 최근 TAILOR 연구에서 NRAS 및 KRAS (exon 3, 4)를 모두 포함한 RAS 야생형 전이성 대장암 환자에서 oxaliplatin, 5-fluorouracil, leucovorin (FOLFOX) 단일치료와 cetuximab과의 병합치료를 비교하였고 병합치료가 질병진행 및 전체 생존율을 향상시키는 효과를 확인하였다[11].
2) 원발 종양 위치에 따른 약제선택
Venook [12]은 2016년 American Society of Clinical Oncology에서 원발 종양 위치에 따른 치료효과 차이를 발표하였다. 특히 cetuximab을 추가한 군에서 원발 종양 위치에 따른 치료효과의 차이가 유의하게 보였는데 우측 대장암에서 cetuximab 치료에 나쁜 예후를 보였다. 여섯 개의 무작위연구(CRYSTAL, FIRE-3, GALGB 80405, PRIME, PEAK, 20050181)들을 모아 후향적으로 분석하였을 때도 같은 결과를 확인했다[13]. ARCAD (Analysis and Research in Cancers of the Digestive System) database로 하는 후향적 연구에서 종양의 위치는 KRAS 야생형에 국한하여 예측인자로 작용했고 이 같은 결과는 cetuximab에 대한 반응에 기인하는 것임을 확인하였다[14]. 후향적 결과임으로 해석에 조심할 필요가 있으나 EGFR 단클론항체와 항암제의 병합요법은 KRAS/NRAS 야생형의 좌측 대장암 환자의 초치료에서만 시행하도록 권고하고 있다.
BRAFV600E 변이는 전이성 대장암의 8–10%에서 발견된다. BRAF 변이는 RAS에 독립적인 MAPK 경로를 활성화하여 암세포 증식과 생존에 영향을 주고 나쁜 예후와 관련된 예후인자로 작용한다[15]. BRAFnon-V600 변이는 전이성 대장암의 2%에서 보이고 전체 BRAF 변이의 22%를 차지한다. BRAFV600E와 비교하여 생물학적 임상적 특징이 다르고 치료에 대한 결과에도 차이가 있다. BRAFnon-V600 변이를 가진 암은 좌측 대장암에 많고, 저등급의 분화를 보이고 좋은 예후와 관련이 있다. 또한 BRAF 억제제에 저항성을 가지며 일부는 EGFR 차단제에 감수성을 보인다[16]. BRAF 융합 유전자도 보고되었는데 이러한 유전자 변이를 보이는 대장암은 우측에 호발하고, EGFR 차단제에 저항성을 보인다.
BRAFV600E 변이를 가진 대장암은 고령, 여성, 우측 종양, 점액성일 경우가 많고 복막전이와 원격림프절 전이가 흔하게 보이나 폐전이는 적다[17]. BRAFV600E 대장암 환자의 약 20%에서 MSI 표현형을 가지며 이런 환자들은 BRAF 변이의 유무와 관계없이 면역항암제에 효과를 보인다[14].
BRAFV600E 변이를 가지는 전이성 대장암 환자는 야생형에 비해 이차 항암치료를 받게 될 확률이 낮아 강화된 초치료가 효과적일 수 있다. 하지만 TRIBE 연구에서 BRAFV600E 변이를 가진 대장암의 일차치료로 oxaliplatin, irinotecan, 5-fluorouracil, leucovorin (FOLFOXIRI)와 bevacizumab를 투여한 군과 irinotecan, 5-fluorouracil, leucovorin (FOLFIRI)와 bevacizumab군을 비교하였을 때 의미 있는 전체 생존율의 향상을 보여주지 못했다[18]. 이후 이어진 TRIBE2 3상 연구에서도 FOLFOXIRI 와 bevacizumab 치료 후 진행된 환자에서 FOLFOXIRI와 bevacizumab을 reinduction한 군과 modified FOLFOX6와 bevacizumab 후 진행되면 FOLFIRI와 bevacizumab를 투여한 군을 비교하였을 때 생존율의 향상을 보여주지는 못했다[19]. 현재 3제 항암제에 추가하여 bevacizumab과 cetuximab을 비교하는 AIO-KRK-0116 (FIRE-4.5) 2상 연구가 진행 중이다.
1) BRAFV600E 변이와 신생혈관억제제
악성종양에서 혈관 생성은 암세포의 증식과 주변 장기로의 침범 및 전이에 중요한 역할을 한다. Vascular endothelial growth factor (VEGF)는 이러한 과정을 조절하는 중요한 인자로 이를 표적으로 하는 단클론항체인 bevacizumab, aflibercept, ramucirumab 등은 VEGF나 VEGF 수용체와 결합하여 혈관생성 과정을 억제한다. 현재 전이성 대장암에서 이와 같은 신생혈관억제제의 효과를 예측할 수 있는 바이오마커가 없고 BRAFV600E를 가진 전이성 대장암 환자들에서의 약제의 효과에 대한 분석연구들도 많지 않다. AVF2017 연구와 AGITG MAX 연구에서 치료받지 않은 전이성 대장암 환자들을 대상으로 IFL (bolus irinotecan, 5-fluorouracil, leucovorin) 혹은 capecitabine에 bevacizumab을 추가한 군과 그렇지 않은 군을 비교하였을 때 생존율의 향상을 보여주지 못했다[20,21]. RAISE (FOLFIRI±ramucirumab) 연구와 VELOUR (FOLFIRI±aflibercept) 연구에서 BRAFV600E 변이를 가진 대장암 환자들의 하위분석 결과 신생혈관억제제가 이차치료에서 효과를 보일 수 있는 가능성을 확인했으나 적은 환자수로 인해 통계학적 의미를 도출하기는 어려웠다[22,23]. 그외 여러 후향적 연구에서 BRAFV600E 변이를 가진 전이성 대장암 환자들의 일차나 이후 치료에서 신생혈관억제제의 효과를 보고했다[24].
2) BRAFV600E 변이와 EGFR 차단제
BRAFV600E를 가진 환자에서 EGFR 차단제와 항암제와의 단일 혹은 병합치료의 효과는 명확하지 않다. 두 개의 메타분석이 시행되었는데, Pietrantonio 등[25]은 BRAFV600E 환자에서 EGFR 차단제가 효과적이지 않다고 보고하였다. 그러나 Rowland 등[26]의 분석에서는 BRAF 야생형과 BRAFV600E 변이를 가진 환자들 간에 EGFR 차단제 효과의 의미 있는 차이를 발견하지 못했다. FIRE-3 연구는 KRAS 야생형의 전이성 대장암의 초치료로 cetuximab와 FOLFIRI의 병합치료를 한 군과 bevacizumab과 FOLFIRI의 병합치료를 한 군의 효과를 비교한 연구로, BRAFV600E 환자군을 후향적으로 분석하였을 때 cetuximab군에서 높은 반응률을 보였다[27]. 최근 VOLFI AIO KRK0109 연구는 일차치료로 FOLFOXIRI와 panitumumab의 단독요법과 병합요법을 비교한 연구로 BRAFV600E 변이를 보이는 환자들의 하위분석에서 panitumumab군에서 높은 반응률을 보였다(71% vs. 22%, n=14) [28].
3) BRAF 억제제
흑색종에서와 달리 BRAF 억제제 단일요법은 대장암에서 실망스러운 결과를 보였다. 원인에 대한 한 가지 가설은 BRAF 억제제가 EGFR 활성화를 유도하고 MAPK 신호전달을 촉진하여 EGFR 매개로한 하위신호의 재활성화로 인해 내재성 내성을 가진다는 것이다[29]. 이를 극복하기 위해 BRAF 억제제(encorafenib), EGFR 차단제, PI3K 억제제 또는 Mitogen-activated protein kinase kinase (MEK) 억제제(binimetinib, trametinib) 등과의 병합요법 연구가 진행되었다[30]. BEACON 3상 연구는 encorafenib, cetuximab, binimetinib군과 encorafenib, cetuximab군 그리고 cetuximab, irinotecan 혹은 FOLFIRI 세 군을 비교하였다. 이전에 일차 혹은 이차 항암치료 후 악화된 665명의 BRAFV600E 환자들을 무작위 분류하였고 실험군의 중앙생존기간은 9.3개월, 대조군은 5.9개월로 확인되었다(위험률, 0.60; 95% 신뢰구간, 0.47–0.75 및 위험률, 0.61; 95% 신뢰구간, 0.48–0.77) [31]. 객관적 반응률은 대조군에서 2%, 2제요법은 20%, 3제요법에는 26%였으나 삶의 질 분석에서는 실험군에서 40% 이상 저하되었다[32]. 이 연구는 두 개의 실험군(2제 및 3제)을 비교하도록 설계되지 않았지만 이익-위험 균형면에서 MEK 억제제 없이 encorafenib과 cetuximab 조합이 선호된다.
약 50%의 전이성 대장암 환자에서 KRAS/NRAS 변이가 보고되었다. 이 환자들은 예후가 나쁘고 EGFR 차단제에 저항성을 보여 치료가 어렵다. 신생혈관억제제가 효과적일 수 있으나 치료에 반응을 예측할 수 있는 바이오마커가 부족하다. KRASG12C는 대장암에서 가장 흔한 KRAS 변이유형으로 새로운 세대의 KRAS 억제제가 이 환자군에서 효과적인 치료의 대안이 될 수 있다[33]. 최근 KRASG12C 억제제의 고무적인 결과가 발표되었다. Sotorasib (AMG510)은 새로운 소분자물로 KRASG12C를 비가역적으로 억제한다. KRASG12C 변이를 가진 고형암을 대상으로 한 연구에서 유망한 임상결과들이 확인되었고 이중 대장암에서는 12% 반응률과 80%의 질병억제 효과를 보였으나 이를 입증하기 위한 대규모의 추가적인 연구가 필요하다[34].
1) MSI와 dMMR
대부분의 대장암은 염색체 불안정 경로(염색체 수적 이상과 소실)를 통해서 발생하지만, 10–15%의 경우 MSI로 발생한다. MSI는 DNA 불일치복구 시스템의 결핍으로 발생하며 린치 증후군과 같은 MMR 유전자(MLH1, PMS2, MSH2, MSH6)의 생식세포의 변이나 MLH1의 후천적 불활성화로 인해 산발적으로 일어난다. 산발적 발생의 경우 BRAFV600E 변이와 연관된 경우가 흔하다[35]. dMMR/MSI는 국소대장암의 10–15%, 전이성 대장암의 4–5%에서 확인되며 주로 근위부 결장에서 발생하고 분화가 나쁘며 종양 침윤 림프구가 풍부하고 원격림프절 전이 및 복막전이가 빈번하게 일어나는 임상적 특징이 있다[16]. 국소 대장암에서는 양호한 예후와 관련이 있고 전이성에서는 논란이 있으나 proficient MMR 혹은 microsatellite stable 환자와 비교하여 항암치료에 낮은 반응률을 보인다는 보고가 많다[36].
dMMR/MSI 대장암은 활성화된 세포독성 T CD8+ 림프구 침윤을 보이고 고도의 immunogenic neoantigen을 가진 높은 종양변이 부담을 가지고 있다. 또한 적대적인 면역미세환경으로부터 암세포를 보호하기 위해 면역관문을 활성화시키기 때문에 면역관문억제제(pembrolizumab, nivolumab)가 효과적인 치료가 될 수 있다[37].
2) 면역관문억제제
암세포 표면에는 PD-L1이라는 면역회피물질이 있으며 이것이 T세포의 PD-1과 결합하면 T세포의 면역기능이 무력화된다. 면역관문억제제는 PD-1이나 PD-L1을 차단하여 암세포의 PD-L1과 T세포의 PD-1의 결합을 막고 T세포의 활성화를 유도하여 종양 억제효과를 가진다.
전이성 대장암에서 dMMR/MSI는 면역관문억제제의 반응을 예측하는 중요한 바이오마커이다. Proficient MMR 혹은 microsatellite stable 대장암이 면역관문억제제에 저항성을 보이는데 반해 dMMR/MSI 대장암은 감수성을 보여 항암에 저항성을 보였던 dMMR/MSI 전이성 대장암 환자에서 면역관문억제제의 효과는 여러 2상 연구에서 확인되었다. 연구결과 객관적 반응률은 33–58%, 12개월 무진행 생존율은 31–71%로 보고되었다[38]. CheckMate-142 연구에서는 nivolumab과 다른 T세포 활성 억제 단백질인 CTLA-4를 억제하는 ipilimumab과의 병합요법의 효과를 보여주었다. 이런 결과들로 인해 항암치료 후 악화된 dMMR/MSI 전이성 대장암 환자에서 pembrolizumab 혹은 nivolumab 단독요법 및 ipilimumab과의 병용요법이 US Food and Drug Administration에서 승인되었다.
이전에 항암을 받은 적이 없는 초치료 환자에서도 면역관문억제제의 효과가 확인되었다. CheckMate-142 연구의 세 번째 코호트에서 45명의 dMMR/MSI 전이성 대장암 환자들이 일차치료로 nivloumab과 ipilimumab을 받았고 반응률 77%, 12개월 무진행생존율은 77%로 고무적인 결과를 보였다[39]. 최근 KEYNOTE-177 3상 연구 결과 pembrolizumab 단독요법군이 표준 항암치료군보다 무진행 생존기간 16.5개월 대 8.2개월로 두 배 이상의 차이를 보여(위험률, 0.60; 95% 신뢰구간, 0.45–0.80) 향후 pembrolizumab이 새로 진단된 dMMR/MSI 전이성 대장암 환자의 새로운 표준치료가 될 것으로 보인다[40].
국소 병기의 dMMR/MSI 대장암 환자에서 면역관문억제제에 대한 연구도 진행되었다. NICHE 2상 연구에서 21명의 dMMR/MSI 초기 대장암 환자에서 선행화학요법으로 nivolumab과 ipilimumab 병합치료 결과 95%에서 주요반응을 보였고 12명은 병리학적 완전반응이 확인되었다[41]. 현재 dMMR/MSI 대장암 3기 환자에서 수술 후 보조항암치료로 기존항암제와 면역관문억제제와의 병용요법에 대한 연구(ATOMIC, POLEM)가 진행 중이다[42].
3) dMMR/MSI 대장암 환자에서 면역관문억제제 반응의 예측 바이오마커
dMMR/MSI 대장암 환자에서 면역관문억제제의 효과를 예측하는 바이오마커는 없으며 저항성 기전에 대해서도 명확하게 알려져 있지 않다. PD-1 발현, beta-2-microglobuin 변이, major histocompatibility complex class I 발현, Janus kinase JAK1/2의 기능소실변이 등이 저항성에 관련되었다는 보고가 있다[43]. 그외 종양변이양이나 T세포의 침윤정도와 반응률과의 관련성에 대한 연구가 있다[44].
약 1–8%의 대장암에서 HER2 유전자 증폭을 보인다[45]. HER2 과발현은 원위부암 특히 직장암, 그리고 KRAS 야생형을 가진 대장암의 4.3–5.4%에서 확인되나 두 가지 유전적 변이가 같이 발견될 수도 있다[46]. HER2 과발현과 예후와 관련된 연구결과는 다양하지만 EGFR 차단제에 잘 듣지않는다는 보고가 우세하다. 대장암에서 HER2 양성의 진단은 Heracles 진단기준에 의하며 면역조직화학검사(immunohistochemistry, IHC) 3+ 혹은 IHC 2+이면서 fluorescence in situ hybridization 양성인 경우 HER2 양성으로 판단한다[47]. HER2 양성 대장암에서 HER2 차단제의 병용요법에 대한 2상 연구(Heracles-A, MyPathway, Mountaneer) 결과 30–55%의 반응률을 보였고[46,48,49], 이중 MyPathway 연구는 KRAS 변이가 있는 HER2 양성 환자도 포함하여 연구를 진행했다. Pertuzumab과 trastuzumab emtansine의 병합요법과 관련된 Heracles-B 연구는 일차 평가변수(반응률)를 만족시키지 못했지만 최근 DESTINY-CRC01 2상 연구 결과 trastuzumab-deruxtecan (HER2 차단제와 topoisomerase I 억제제의 항체약물접합체, antibody-drug conjugate)이 잠재적인 게임 체인저 역할을 할 수 있을 것으로 기대되고 있다. 항암제 저항성을 보이는 HER2 양성 전이성 대장암 환자를 대상으로 한 이 연구에서 45% (24/53)의 반응률을 보였고 이전에 HER2 차단제를 사용한 적이 있는 환자들의 43.8% (7/16)에서 반응을 보였다.
HER2 양성 전이성 대장암 환자에서 HER2 차단제는 매력적인 치료전략이지만 아직 대규모 3상 연구 결과가 부족하여 추가적인 평가가 필요하다. 현재 HER2 양성 RAS/RAF 야생형 전이성 대장암에서 trastuzumab, pertuzumab, irinotecan, cetuximab 병용요법에 대한 2상 연구가 진행중이다.
NTRK 융합유전자는 최근 유망한 치료표적으로 부상하였다. Tropomyosin receptor kinase (TRK) 억제제(larotrectinib, entrectinib)는 암의 조직 타입에 관련없이 NTRK 융합유전자를 가진 환자군에서 인상적인 임상효과를 보여주었다. 단일군 연구에서 larotrectinib는 75%의 객관적 반응률을 보여주었고 73%의 환자에서 6개월 이상 반응이 유지되었다. Entrectinib도 57%의 반응률을 보였고 68% 환자에서 6개월 이상 반응이 지속되었다[50,51]. 이 결과로 암종 관계없이 NTRK 융합유전자가 확인된 난치성 고형암 환자의 치료에 US Food and Drug Administration의 신속승인을 받았다. NTRK 융합유전자의 선별검사는 융합의 정도에 따라 fluorescence in situ hybridization, RT-PCR, next-generation sequencing으로 가능하다[52]. 대장암에서 발현빈도는 0.23–0.97% 정도로 드물기 때문에 선택된 선별검사가 필요하다.
NTRK 융합유전자 양성 대장암 환자들은 여성, 우측대장암, RAS/RAF 야생형, MSI 표현형의 임상특징을 가진다[53]. MSI 표현형과 NTRK 융합유전자의 관련성은 일관되게 보고되고 있으며 더 정확하게는 MLH1 유전자의 hypermethylation을 가진 BRAF 야생형 암과 연관되어 있다. 이같이 선별된 환자군에서 NTRK 융합유전자는 약 42% 정도에서 확인되며[54], 아직 이 환자군에서 NTRK 억제제나 면역관문억제제의 효과에 관한 데이터는 없다.
결 론
지난 10년간 전이성 대장암 환자의 치료에 상당한 발전이 있었다. EGFR 차단제에 반응이 있는 환자들은 바이오마커가 다양해지면서 맟춤치료를 선택할 수 있게 되었고 그동안 효과적인 표적치료가 없었던 BRAFV600E 변이를 가진 전이성 대장암 환자들도 병합요법의 효과를 보였다. 드물지만 HER2 유전자 증폭 및 NTRK 융합유전자 등의 새로운 표적이 치료 효과를 기대할 수 있게 되었다(Table 1). 또한 dMMR/MSI 대장암 환자에게 면역관문억제제의 사용은 치료에 획기적인 진전을 가져왔고 pseudoprogression 현상 및 장기생존 등에 대한 논의의 필요성이 강조되어 새로운 연구 디자인과 사전에 계획된 통계분석이 중요하게 되었다[55].
축적된 분자생물학적 데이터들을 통합하여 2015년 Louis Vermeulen과 Sabine Tejpar 그룹은 공동연구를 통해 대장암을 새로운 분자생물학적 분류기준(consensus molecular subtypes, CMS)으로 네 가지 아형으로 분류하였다. CMS1 (MSI immune), CMS2 (canonical), CMS3 (metabolic), CMS4 (mesenchymal)로 나뉘는 CMS 분류는 아직 연구영역 이외 치료영역에는 명확하게 정의되지 않았지만 생물학적 특성을 예측하고 궁극적으로 예후 판정 및 치료방침 설정에 대한 전반적인 과정을 개선시켜 향후 일반 치료영역에서도 중요성이 입증될 것으로 기대한다. 중개연구를 통해 대장암의 생물학적 다양성과 선천적 및 후천적 저항성 기전들이 밝혀질수록 환자 맞춤형 개별 치료전략이 점차 가능해질 것이다.